EquiBind è 1200 volte più veloce dei modelli computazionali tradizionali finora utilizzati. Relay Therapeutics lo sta già testando su una proteina e un farmaco esistenti per leucemia, cancro ai polmoni e tumori gastrointestinali
Un nuovo modello geometrico di deep learning 1.200 volte più veloce e più accurato dei modelli computazionali tradizionali per trovare potenziali trattamenti farmacologici per le malattie. Si chiama EquiBind ed è contenuto in un documento del MIT presentato alla Conferenza internazionale sull’apprendimento automatico.
I ricercatori hanno sviluppato un modello geometrico di deep learning che è 1.200 volte più veloce di QuickVina2-W, l’attuale modello di docking molecolare computazionale utilizzato per legare le molecole alle proteine.
L’AI nello sviluppo di nuovi farmaci
Trovare trattamenti per i pazienti in genere comporta la configurazione di molecole per combattere le malattie. Ma il numero di molecole che possono potenzialmente essere sviluppate per i numeri dei trattamenti farmacologici è gigantesco: 10 alla60a potenza.
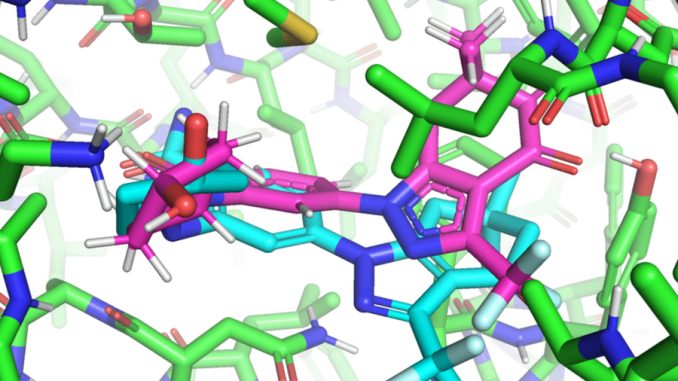
Per sviluppare farmaci, i ricercatori devono prima identificare potenziali molecole che agiscono come farmaci che possono “agganciarsi” o “legarsi” a determinate proteine prese di mira. Dopo l’attracco alla proteina, il farmaco legante può fermare una proteina malfunzionante o anormale e proteggere il corpo umano.
Il processo di solito richiede più di 10 anni per lo sviluppo di farmaci e test clinici prima che il trattamento farmacologico sia approvato dalla Food and Drug Administration. Circa il 90% di tutti i farmaci non sarà efficace sugli esseri umani a causa del fatto che non ha alcun impatto o troppi effetti collaterali. Il processo di scoperta dei farmaci costa miliardi di dollari e lo sforzo computazionale è colossale, facendo salire i prezzi dei farmaci che funzionano.
Come funziona EquiBind
Al contrario, EquiBind “prevede la posizione precisa della chiave in un singolo passaggio senza previa conoscenza della tasca bersaglio della proteina”, un processo noto come “aggancio cieco”. Ciò è dovuto al ragionamento geometrico integrato di EquiBind che “aiuta il modello a imparare la fisica sottostante delle molecole e a generalizzare con successo per fare previsioni migliori quando incontra dati nuovi e invisibili”.
Le aziende biofarmaceutiche stanno già mostrando interesse per il modello geometrico di deep learning. Relay Therapeutics sta testando il modello su una proteina e un farmaco esistenti che funzionano per la leucemia, il cancro ai polmoni e i tumori gastrointestinali. EquiBind ha avuto successo mentre molti dei metodi di docking tradizionali utilizzati per legare i ligandi alle proteine non hanno funzionato.
AI 4 Business, Pierluigi Sandonnini – 28.7.2022